(文章来源:bioprint菌)
? ? ?? 血栓及其并发症是心血管疾病发病率和死亡率的主要原因之一。虽然急性血栓事件可能需要使用溶栓剂(如组织纤溶酶原激活剂(TPA))治疗,但是血栓不能被完全去除,残余的血栓会随着时间的推移通过周围组织侵入的成纤维细胞发生纤维改变,最终形成永久性的血栓。如果形成静脉壁僵硬和静脉高血压,这在临床上表现为血栓形成后综合征,引起水肿,疼痛,严重者还会面临截肢。
目前,建立一个体外仿生平台来研究血栓形成中的细胞相互作用和潜在疗法方面是非常必要的,然而在模拟血管的各种结构和生物方面以及利用相对复杂的制造过程的能力方面受到限制。
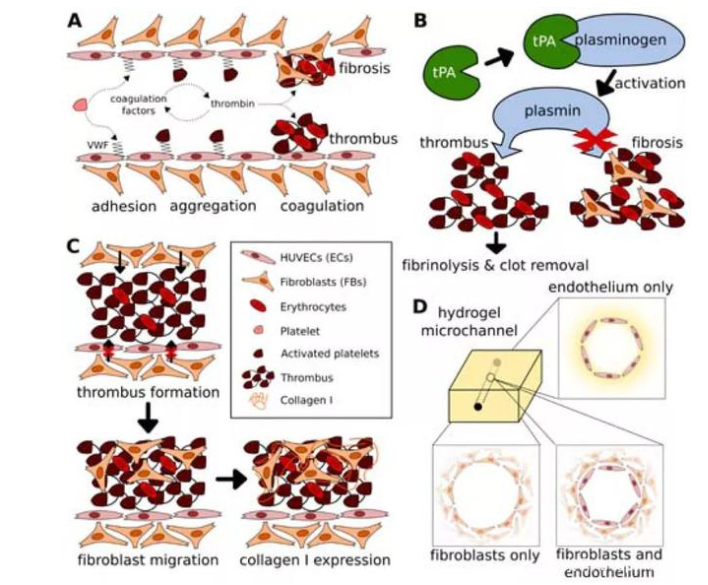
因此,Yu Shrike Zhang团队开发了一种利用3D打印技术以构建高度仿生血栓-芯片模型的方法。该模型是由一层融合的人内皮细胞包覆在明胶甲基丙烯酰基(GelMA)水凝胶中的空心微通道组成,其中人全血被注入并诱导形成。组织纤溶酶原激活剂的持续灌注导致非纤维化凝块的溶解,说明了该模型的临床相关性。进一步将成纤维细胞包裹在GelMA基质中,表明这些细胞有可能迁移到凝块中,随后随着时间的推移沉积I型胶原,从而促进纤维细胞的形成。该模型在用于研究血管纤维化病理方面有重大的意义。
首先,研究团队进行了血管化结构的3D打印。该结构是用Pluronic沉积了一个由牺牲支架组成的模具,并使其干燥过夜。随后,将GelMA溶液填充模具并使用光交联引发凝胶化。通过将整个构建体浸入冷的PBS中去除Pluronic结构,形成了水凝胶微通道。同时为了模拟内皮功能,研究人员将表达GFP的HUVECs接种到微通道中并培养直至达到汇合。结果显示,HUVECs在播种后不久就开始在微通道内表面上扩散,直到第2天沿微通道的长度形成汇合的内皮层。对于分叉通道,在整个微通道上都观察到了类似的趋势,包括分叉点。
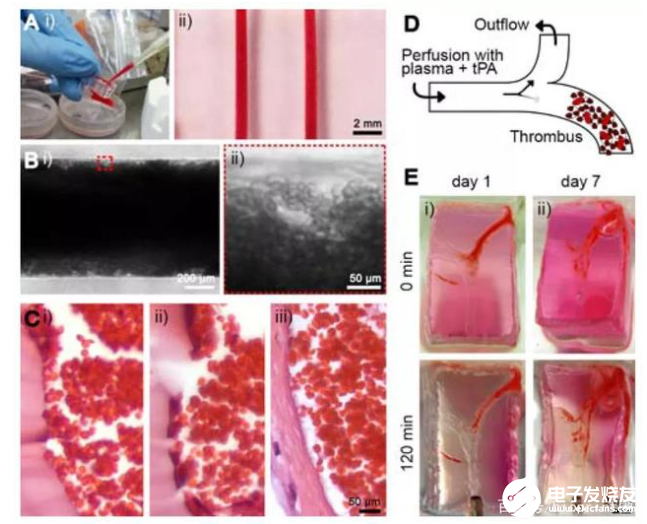
然后,研究人员探讨了血管化水凝胶微通道作为研究血栓形成模型的潜在应用。对于芯片上的血栓形成模型来说,重要的是用血栓溶解剂治疗后的凝块的体内血栓溶解活性;对于溶栓实验来说,通过采用分叉型微通道配置可以验证芯片上的血栓形成模型中TPA的溶栓潜力。结果表明,利用牺牲性生物打印制作的体外分叉血栓形成模型的仿生特性,在研究血栓形成,溶栓和相关病理学方面有巨大的潜在用途。
最后,为了验证内皮的完整性受到损害时,在水凝胶微通道基质中包被的成纤维细胞会迁移到血管腔中促进血栓纤维化这一假设。研究人员制作了三种类型的模型:i)在水凝胶中没有成纤维细胞的内皮化微通道作为对照;ii)非内皮化微通道,在基质中具有成纤维细胞以模拟受损血管;iii)内皮化的微通道在基质中具有成纤维细胞,以模仿正常血管。这项研究中描述的仿生人类单片血栓形成模型为今后研究提供了开展体外研究的能力,特别在发展个性化血管疾病建模方面有重大进展。
? ? ? (责任编辑:fqj)